- Nature communications发表上海设施五线六站用户张鹏研究员文章
2015年7月22日,Nature communications发表了国家蛋白质科学研究(上海)设施五线六站用户中科院上海生科院植物生理生态研究所张鹏研究组题为“Structures of FolT at substrate-bound and -released conformations reveal a gating mechanism of ECF transporters”的研究论文。该研究通过解析叶酸ECF转运蛋白复合体中底物结合蛋白FolT与底物叶酸结合状态的晶体结构以及生化分析比较,揭示了ECF转运蛋白底物结合与释放的门控机制。
ECF转运蛋白属于一类新型ABC转运蛋白,广泛存在于微生物和植物体中,负责维生素类营养物质的跨膜运输。完整的ECF转运蛋白由细胞膜上的底物结合蛋白EcfS和由膜蛋白EcfT、胞内的ATP结合蛋白EcfA/EcfA’组成的ECF模块构成。张鹏课题组在ECF型ABC转运蛋白跨膜转运分子机理的研究中取得了一系列进展:解析了叶酸ECF转运蛋白复合体面向细胞内底物释放状态的晶体结构,提出了ECF转运蛋白的工作模型(底物转运通过S蛋白在膜内的翻转实现)(Xu et al., Nature, 2013. Zhang et al., Trends Microbio, 2013);阐明了group II ECF转运蛋白多个底物结合蛋白EcfS共享同一ECF模块的结构基础(Zhang et al., PNAS, 2014)。然而,由于缺少转运同一种底物的ECF转运蛋白不同状态的结构信息,人们对底物结合和释放的机制一直不清楚。
在本项工作中,张鹏研究组的博士研究生赵琴和王程程等解析了叶酸ECF转运蛋白复合体中的底物结合蛋白FolT叶酸结合状态的晶体结构。研究人员通过结构分析揭示了叶酸在FolT上的结合位点和与之特异性作用的氨基酸;利用等温滴定微热量技术测定了这些氨基酸突变对叶酸结合力的影响;进而通过将此结构与他们之前解析的不结合叶酸的FolT结构进行比较分析,发现连接跨膜螺旋1、2的L1 loop在叶酸结合前后发生了很大的构象改变。基于结构比较与生化分析结果,研究人员提出了叶酸ECF转运蛋白底物结合与释放的门控机制:即L1 loop是负责叶酸结合与释放的门控开关。在叶酸结合时,位于L1 Loop上的Arg26和Lys36与叶酸分子形成盐桥与氢键作用,使L1 Loop覆盖于叶酸结合位点上方并呈关闭状态;ATP水解产生的构象变化最终导致Arg26和Lys36与叶酸的结合被打破,L1 loop的构象从关闭状态变为开放状态,这使FolT对叶酸的结合力大大降低(Arg26和Lys36单突变可致FolT与叶酸的结合力分别下降到原来的1/10和1/100),从而使叶酸释放。分析发现EcfS蛋白通常都含有一个连接跨膜螺旋1和2的L1 loop,因此这一底物结合与释放的门控机制很可能在ECF转运蛋白家族普遍存在。
上海设施五线六站晶体学线站(BL19U1)在晶体结构解析等方面提供了强有力的实验条件支持,为成果的发表做出了积极的贡献。自开放以来,三条晶体学线站已接到了来自两岸三地各科研院所、学校及商业用户近130个用户的申请,提供机时约3600小时。
原文链接:http://www.nature.com/ncomms/2015/150722/ncomms8661/full/ncomms8661.html
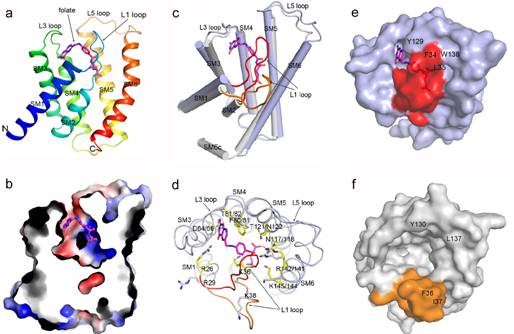
(a)EfFolT的整体结构,叶酸用洋红色棍棒模型表示;(b)横截面图显示叶酸在FolT上的结合位点;(c)叶酸结合状态(EfFolT-蓝色,L1 loop呈关闭状态)和释放状态(LbFolT-灰色, L1 loop呈开放状态)的结构叠合比较图,L1 loop分别用红色和橙色表示;(d) c图的顶端俯视图显示与叶酸结合的氨基酸残基和构象变化;(e)处于L1关闭状态时叶酸结合位点俯视图;(f)处于L1开放状态时叶酸结合位点俯视图。
 ©1996 - 中国科学院 版权所有 京ICP备05002857号-1 京公网安备110402500047号 网站标识码bm48000017
©1996 - 中国科学院 版权所有 京ICP备05002857号-1 京公网安备110402500047号 网站标识码bm48000017