- 上海设施五线六站用户在CELL杂志发表研究成果
2015年10月15日,国际学术期刊Cell在线发表了国家蛋白质科学研究(上海)设施(简称“上海设施”)五线六站用户中国科学院生物物理研究所核酸生物学重点实验室王艳丽研究组的最新研究成果:“Structural and Mechanistic Basis of PAM-dependent Spacer Acquisition in CRISPR-Cas Systems”,该研究工作揭示了CRISPR-Cas系统中外源DNA获取的结构基础和分子机制。
原核生物的基因组中成簇有规律的间隔短回文重复序列(CRISPR)及其辅助蛋白(Cas蛋白)构成了一道重要的免疫屏障,使细菌和古菌的原核生物免受外界病毒(如噬菌体等)的侵染。该免疫系统发挥作用分三步进行:首先,Cas1和Cas2组成核心蛋白复合物,将入侵宿主的外源DNA片段进行加工,随后整合到位于宿主基因组上CRISPR位点,这一过程被称为获取阶段。其次,宿主表达相关的Cas蛋白,同时转录并加工出成熟的crRNA,形成干扰复合体。最后,当外源DNA再次入侵时,由crRNA介导的干扰复合体将其识别并降解,以保护宿主免遭损伤。随着近年来研究的不断深入,CRISPR-Cas系统中一系列重要蛋白及复合物的结构逐渐被报道,人们对于crRNA的加工机制和干扰复合物的形成有了较为清晰的了解。然而,对于Cas1和Cas2如何获取外源DNA片段,仍知之甚少 。因此,研究获取阶段的结构与分子机制有助于我们完善对CRISPR-Cas系统的认识。
在本研究中,王久宇和李佳智等人在王艳丽研究员的指导下,通过解析Cas1-Cas2与多种DNA的复合物的晶体结构,证明外源DNA片段以一种两端分叉的构象被Cas1和Cas2组成的复合物所获取。在Cas1-Cas2-DNA的结构中,两个Cas1的酪氨酸残基与Cas2分子共同构成卡尺模型,准确度量出23 bp的DNA双链部分;DNA的3’单链部分,通过Cas1分子Lys211、Tyr217等氨基酸残基对PAM互补序列(5’-CTT-3’)序列特异性识别,深入到由His208、Glu141和Asp221组成Cas1的活性中心,在两端分别切割留下5nt,与之前的双链部分共同构成33 nt的获取片段。在这一过程中,由于结合底物DNA,Cas1-Cas2发生了明显的构象变化,该变化可比作蝴蝶飞舞时由“翅膀扬起”到“翅膀展平”的状态。最终,在Cas1-Cas2的介导下,外源DNA通过“切割-粘贴”的机制插入到宿主的CRISPR位点。该研究通过结构和生化分析,揭示了Cas1-Cas2获取外源DNA片段的分子机制,阐明外源DNA片段的度量机理,为完整揭示原核生物CRISPR-Cas系统奠定了重要的理论基础。
该项研究是在上海设施BL18U1、BL-19U1和上海光源17U等其他相关线站上进行的。在实验方面,线站工作人员提供了强有力的专业技术支持,为成果的发表做出了积极贡献。该研究还得到科技部、国家自然科学基金以及中国科学院战略性先导科技专项(B类)的资助。
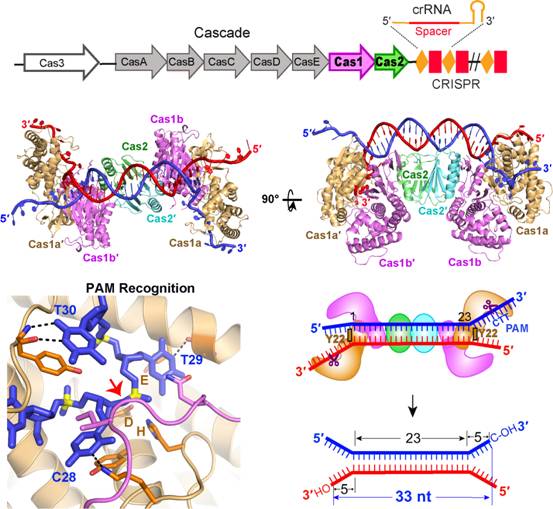
图注:E. coli Cas1-Cas2蛋白与具有双叉结构的间隔区前体DNA复合物的晶体结构。Cas1-Cas2特异性的识别并结合含有PAM互补序列DNA,进而确定间隔区前体的长度并将其插入到CRISPR-Cas位点。
 ©1996 - 中国科学院 版权所有 京ICP备05002857号-1 京公网安备110402500047号 网站标识码bm48000017
©1996 - 中国科学院 版权所有 京ICP备05002857号-1 京公网安备110402500047号 网站标识码bm48000017